La coagulopatía asociada a COVID-19 (CAC por sus siglas en inglés) y la coagulación intravascular diseminada (CID) son fenómenos comunes en COVID-19 y están asociados con una mayor gravedad de la enfermedad y un mayor riesgo de muerte.
Manifestaciones clínicas:
La presentación clínica de CAC es la de un estado altamente protrombótico. La evidencia anecdótica indica que los pacientes críticos con COVID-19 sin otros factores de riesgo de trombosis se manifiestan con varios eventos trombóticos que incluyen trombosis microvascular, tromboembolismo venoso y pulmonar y trombosis arterial aguda.
Los principales problemas incluyen:
- trombosis asociada al catéter
- coagulación de los catéteres de acceso vascular y los circuitos de diálisis que conducen a la interrupción frecuente de la terapia de reemplazo renal continuo (CRRT)
- necesidad de reemplazo de catéter.
Dos estudios recientes respaldan esta impresión clínica, informando una tasa de trombosis venosa profunda (TVP) del 25% y tasas de incidencia acumulada de TVP, embolia pulmonar y trombosis arterial del 31%; y el 81% de los eventos reportados por Klok et al fueron tromboembolias pulmonares 1,2.
En las UCI de la Clínica Cleveland, se ha descubierto que la ecografía en el punto de atención (POCUS) detecta tasas similares de TVP (estimado del 25% al 30%) y hallazgos frecuentes de "flujo venoso lento". Este patrón, descrito como ecogenicidad amorfa en las venas principales, se ha asociado con una mayor tasa de TVP en exámenes posteriores.
Hallazgos de laboratorio:
Los hallazgos característicos de laboratorio de CAC son niveles dramáticamente elevados de dímero D y productos de degradación de fibrina, proyectando una imagen de un estado altamente protrombótico con un alto recambio de fibrina. Por el contrario, otros marcadores de CID permanecen relativamente sin cambios. El tiempo de protrombina (TP) y el tiempo de tromboplastina parcial activada (TTPa) solo se prolongan levemente, si es que lo hacen, y los recuentos de plaquetas generalmente son normales o solo disminuyen ligeramente (100 a 150 × 109 / L).
Los niveles elevados de dímero D en la presentación con COVID-19 se asocian con una enfermedad más grave (dímero D mayor de 0.5 ?g / ml en el 60% de los pacientes con enfermedad grave frente al 43% con enfermedad leve), la necesidad de un nivel de UCI de atención y se correlacionan con la mortalidad general. En un análisis de regresión multivariable de 191 pacientes, Zhou et al informaron un odds ratio de muerte de 18.42 (2.64–128.55) para pacientes con un dímero D> 1 ?g / ml frente a <0.5 ?g / ml al ingreso.
Los niveles de dímero D también se correlacionan con el riesgo de tromboembolismo venoso (TEV), con una sensibilidad, especificidad y valor predictivo positivo reportados de 70.0%, 96.7% y 87.5%, respectivamente para un nivel de dímero D de 3.0 ?g / mL. Los pacientes en este estudio, sin embargo, no recibieron profilaxis de TEV de rutina.
Klok et al no informaron los niveles de dímero D, pero informaron que la coagulopatía (prolongación de PT> 3 o aPTT> 5 segundos) es un factor de riesgo independiente para la trombosis.
En una serie de casos de 3 pacientes con isquemia de las extremidades inferiores se describió una asociación de anticuerpos antifosfolípidos (inmunoglobulina anti-cardiolipina A [IgA], anti-beta-2-glucoproteína I IgA e IgG positivas, lupus anticoagulante negativo) y coagulopatía de COVID-19.
Un estudio reciente que incluyó a 150 pacientes de UCI en Francia mostró una tasa notablemente alta de pruebas positivas para el anticoagulante lúpico; 50 de los 57 pacientes a los que se les realizó una prueba de anticoagulante lúpico (87.7%) para evaluar más a fondo un TTPa elevado, dieron positivo.
El 71.4% de todos los no sobrevivientes, en comparación con solo el 0.6% de los sobrevivientes, muestran una progresión de la coagulopatía a una CID manifiesta, según lo indicado por una puntuación de CID de la Sociedad Internacional de Trombosis y Hemostasia (ISTH) de 5 puntos o más.
La progresión de la coagulopatía a una CID, con niveles decrecientes de antitrombina III, un aumento en PT y aPTT, y un aumento dramático adicional del dímero D (> 15.0 ?g / mL) parece ser un indicador de enfermedad grave y progresiva, y mostró desarrollarse de forma tardía en el curso de la enfermedad (días 10 a 14) de los pacientes no sobrevivientes.
Los niveles de fibrinógeno, que están elevados en la fase inicial, mostraron un declive en pacientes no sobrevivientes y pueden ser un indicador de muerte inminente.
Un metaanálisis reciente de 9 estudios con 1.779 pacientes con COVID-19 examinó la trombocitopenia como marcador de la gravedad de la enfermedad. La trombocitopenia en la presentación clínica se asoció con un mayor riesgo de enfermedad grave y muerte, con una diferencia media de 31 × 109 / L entre enfermedad grave y no grave. Los autores observaron una gran heterogeneidad entre los estudios, con tasas informadas de trombocitopenia en la enfermedad grave que van del 4% al 57%.
Histopatología:
Los primeros informes de histopatología describen hallazgos de daño alveolar difuso con inflamación profunda, trombosis y microangiopatía trombótica de pequeños vasos y capilares pulmonares. También se han observado megacariocitos dentro de los capilares pulmonares con hipercromasia nuclear y atipia, así como neutrófilos parcialmente degenerados y atrapados en fibras, lo que sugiere trampas extracelulares de neutrófilos.
La lesión de las células endoteliales y la trombosis microvascular difusa sugestiva de microangiopatía trombótica también se informa en órganos extrapulmonares y pueden explicar la aparición aguda de insuficiencia multiorgánica sin una etiología obvia.
Patofisiología:
El CAC es probablemente multifactorial, y los pacientes con COVID-19 comparten muchos de los factores de riesgo clásicos de TEV observados en el síndrome de dificultad respiratoria del adulto (SDRA) por otras causas, es decir, inmovilización, catéteres grandes de acceso vascular e inflamación sistémica. El sello distintivo de COVID-19 es la inflamación profunda, descrita como "tormenta de citoquinas", caracterizada por altos niveles de Il-1, Il-6, factor de necrosis tumoral alfa y otras citocinas inflamatorias. Se sabe que la inflamación promueve la trombosis a través de varios mecanismos , incluida la activación del endotelio, las plaquetas, los monocitos y la vía del factor tisular / factor VIIa, así como la alteración de la fibrinólisis y las vías anticoagulantes naturales (trombomodulina, proteínas C y S, inhibidor de la vía del factor tisular) . La inflamación intensa con trombosis de los vasos pulmonares también se observa en el SDRA de otras etiologías y queda por ver si estos hallazgos representan un fenotipo distinto exclusivo de COVID-19, o son un indicador general de la gravedad de la inflamación de COVID-19.
El perfil proteómico en el suero de pacientes con síndrome respiratorio agudo severo (SRAS) identificó un fragmento N-terminal del complemento C3C-alfa, un componente central de la vía del complemento, como un biomarcador sensible del SARS temprano. En modelos murinos de SARS-CoV y de Síndrome respiratorio agudo de Oriente Medio se ha demostrado que la activación del complemento es un contribuyente importante a la lesión pulmonar y a la falla de otros órganos. La inhibición del complemento en estos modelos redujo el daño e inflamación de los órganos.
Se ha sugerido el uso terapéutico del bloqueo del complemento en COVID-19, pero deben evaluarse los resultados clínicos.
Un mecanismo de trombosis microvascular que puede ser específico para el SARS-CoV es su afinidad por la enzima convertidora de angiotensina 2 (ACE2), que se expresa en las células epiteliales alveolares tipo II y en varios tejidos extrapulmonares, incluidas las células endoteliales. La activación de las células endoteliales puede representar un mecanismo único de lesión microvascular mediada por COVID-19, trombosis y posterior falla orgánica multisistémica.
La tasa de 87.7% de pacientes con anticoagulante positivo para lupus reportados por Helms et al. es sorprendente y necesita ser verificada, pero nuevamente señala un papel importante de la lesión endotelial como un mecanismo clave de la falla multiorgánica y la coagulopatía de COVID-19.3
El modelo de "two-hit" (traducido como dos golpes) de la trombosis asociada con el síndrome antifosfolípido propone que después de un primer golpe se causa daño al endotelio, de manera que los anticuerpos antifosfolípidos potencian la formación de trombos como un segundo golpe.
La activación del sistema de contacto debido a la mayor permeabilidad vascular y la microangiopatía trombótica justifican una mayor investigación.
Manejo:
En la actualidad, solo hay datos limitados para guiar eficazmente la gestión de CAC. El enfoque descrito a continuación describe el consenso de la Clínica Cleveland basado en los datos disponibles y en la experiencia anecdótica. Intenta equilibrar el riesgo y los beneficios de la terapia empírica, al tiempo que minimiza el uso de recursos (como el equipo de protección personal) y la exposición de los cuidadores al COVID-19.
Las estrategias de manejo actualmente varían mucho entre las instituciones y es probable que cambien a medida que aprendamos más sobre esta nueva enfermedad en el futuro cercano.
Pruebas de laboratorio:
Con base en los hallazgos característicos de laboratorio de CAC descritos anteriormente, controlamos el dímero D, el fibrinógeno, la relación normalizada internacional TP y el TTPa cada 48 horas. Definimos un dímero D al menos 6 veces el límite superior de la normalidad (3.000 ng / ml de unidades equivalentes de fibrinógeno [FEU]) como el valor umbral para definir pacientes de alto riesgo.
Actualmente no hay datos para guiar cómo abordar un patrón hipercoagulable en las pruebas viscoelásticas (tromboelastografía o tromboelastometría rotacional). En línea con la orientación actual de la Sociedad Americana de Hematología (ASH) y la ISTH, no se usan rutinariamente pruebas viscoelásticas para evaluar la hipercoagulabilidad.
Dado que los anticuerpos antifosfolípidos y el anticoagulante lúpico se han reportado en COVID-19, se recomienda realizar pruebas para estos, si el TTPa está espontáneamente elevado, y se prefiere el uso de ensayos anti-Xa para controlar la anticoagulación. Sin embargo, el ensayo anti-Xa puede verse afectado por altos niveles de bilirrubina (6.6 mg / dL) o triglicéridos (> 360 mg / dL) que a menudo están elevados en pacientes con COVID-19 con tormenta de citoquinas. Por lo tanto, los niveles de triglicéridos deben controlarse de forma rutinaria y considerarse como una posible fuente de error en pacientes con anticoagulación que son difíciles de mantener dentro del rango objetivo terapéutico.
Imagenología:
Para limitar la exposición del personal, se minimizaron los estudios vasculares formales junto a la cama o el hecho de trasladarse fuera de la UCI para una angiografía tomográfica computarizada; en cambio, se depende en gran medida del POCUS para evaluar la evidencia de TEV siempre que sea posible.
Los pacientes de alto riesgo (dímero D mayor de 3,000 ng / mL FEU) son evaluados para TVP usando un examen POCUS de compresión de 3 puntos de las extremidades inferiores bilaterales. También se recomienda un examen de TVP POCUS y una ecocardiografía para cualquier paciente con disminución cardiopulmonar repentina que no pueda explicarse por una etiología alternativa. Un POCUS positivo es altamente específico y no requiere confirmación por ecografía vascular formal.
Dada la alta incidencia de embolia pulmonar descrita, los estudios confirmatorios (ultrasonografía vascular formal o angiografía tomográfica computarizada) están justificados en casos con contraindicaciones para la anticoagulación empírica y alta sospecha clínica de TEV a pesar de tener POCUS negativo, o si el POCUS no está disponible.
El POCUS debe combinarse con otros cuidados (por ejemplo, acceso vascular guiado por ecografía), para minimizar el uso de equipo de protección personal y la exposición del cuidador al COVID-19 tanto como sea posible.
Tratamiento:
La anticoagulación con heparina parece ser la respuesta obvia a dicho proceso hipercoagulable. La heparina inhibe la activación de neutrófilos, se une a las citocinas inflamatorias y reduce la activación endotelial. Los modelos experimentales también han demostrado que la heparina se une directamente a la proteína-espiga1 del SARS-CoV, que actúa como el sitio de anclaje viral para la interacción SARS-CoV-ACE2 y, por lo tanto, bloquea la entrada celular.
Aunque prometedores, algunos efectos de la heparina aún no se han demostrado en la práctica clínica, y los datos específicos sobre el tratamiento de la CAC son extremadamente limitados.
En un estudio los autores concluyeron que la heparina mejora las tasas de mortalidad en pacientes con COVID-19 grave y citaron una declaración de consenso China que recomienda la anticoagulación en COVID-19. Sin embargo, se debe enfatizar que este estudio comparó retrospectivamente la profilaxis con heparina frente a la no profilaxis, por lo que no está claro si la anticoagulación terapéutica proporcionaría un beneficio adicional 4
También se ha sugerido la trombólisis en pacientes que se deterioran a pesar de la anticoagulación. Una pequeña serie de casos de pacientes con hipoxia severa persistente y dímero D notablemente elevado mostró una mejoría en la oxigenación después de una dosis baja de activador de plasminógeno tisular. A pesar de la mejoría inicial y sin efectos adversos informados, el resultado final en esta serie fue deficiente 5
Dada esta falta de evidencia, la ASH y la ISTH actualmente no recomiendan el tratamiento más allá de la profilaxis estándar a menos que haya una indicación establecida. Ambas sociedades recomiendan la profilaxis contra el TVP en todos los pacientes al ingreso que usan heparina de bajo peso molecular (heparina no fraccionada HNF en insuficiencia renal, fondaparinux en trombocitopenia inducida por heparina) y enfatizan que la profilaxis debe continuar incluso en el contexto de trombocitopenia (recuento de plaquetas> 25 × 109 / L).
El enfoque en este artículo se basa en la detección de POCUS para TEV y la profilaxis intensificada en pacientes de alto riesgo. Dividiendo a los pacientes en 3 categorías:
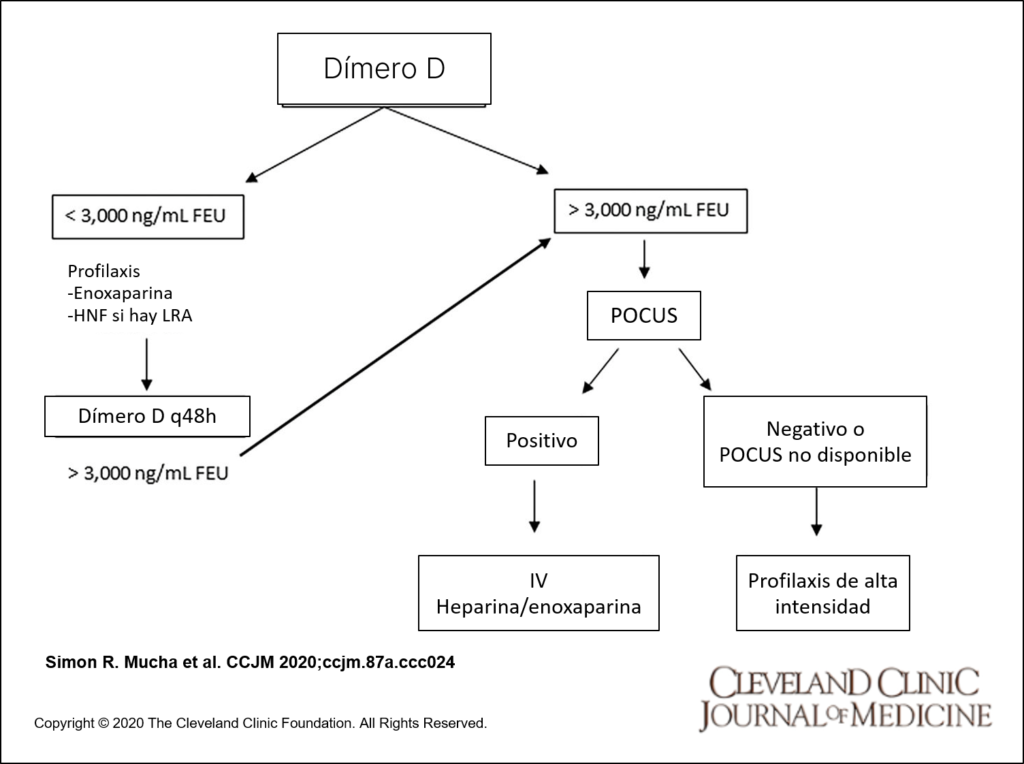
- Categoría 1: dímero D mayor de 3.000 ng / ml de FEU y sin evidencia de TEV. Los pacientes en la categoría 1 reciben profilaxis de TVP estándar y se monitorean mediante pruebas de dímero D en serie.
- Categoría 2: dímero D mayor de 3.000 ng / ml FEU, POCUS negativo. Los pacientes en la categoría 2 reciben profilaxis intensiva de TVP.
- Categoría 3: Los pacientes con trombosis confirmada reciben anticoagulación completa.
En pacientes con alta sospecha clínica de TEV y sin contraindicación para la anticoagulación, la anticoagulación completa debe iniciarse empíricamente, si el POCUS o las pruebas confirmatorias no están disponibles de inmediato.
Terapia de reemplazo renal continuo
Dada la alta tasa de coagulación en los circuitos de diálisis, todos los pacientes en terapia de reemplazo renal continuo recibieron heparina no fraccionada a una tasa de 500 U / h. Si se observa coagulación continua, se aumenta la heparina sistémica para moderar el rango objetivo de tiempo de tromboplastina parcial activada TTPa (nomograma de síndrome coronario agudo). El TTPa buscado puede ajustarse si la coagulación continúa a pesar de la heparina sistémica.
Duración de anticoagulación
La anticoagulación debe continuarse durante 6 semanas para la trombosis asociada al catéter y al menos 3 meses para TEV. Los pacientes convalecientes con dímero D persistentemente elevado (más de 2 veces el límite superior de lo normal) pueden beneficiarse de la profilaxis o el tratamiento extendidos.
El manejo actual se basa en gran medida en los informes de casos y la experiencia anecdótica, y se necesitan urgentemente estudios controlados para guiar mejor la atención.
Las recomendaciones ofrecidas no pueden ser sustituidas por el juicio clínico de los médicos que atienden a pacientes según su situación clínica particular.
Fuentes
Coagulopathy in COVID-19.
- Klok FA, Kruip MJ, van der Meer NJ, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020; Apr 10. doi: 10.1016/j.thromres.2020.04.013CrossRefPubMedGoogle Scholar
- Cui S, Chen S, Li X, Liu S, Wang F. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost 2020; Apr 9. doi: 10.1111/jth.14830CrossRefGoogle Scholar
- Helms J, Tacquard D, Severac F, et al. High risk of thrombosis in patients in severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med 2020. doi: 10.1007/s00134-020-06062-xCrossRefGoogle Scholar
- Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020; Mar 27. doi: 10.1111/jth.14817
- Wang J, Hajizadeh N, Moore EE, et al. Tissue plasminogen activator (tPA) treatment for COVID-19 associated acute respiratory distress syndrome (ARDS): a case series J Thromb Haemost 2020; Apr 8. doi: 10.1111/jth.14828






